Abréviations
BBNS : bêtabloquants non cardiosélectifs
EH : encéphalopathie hépatique
EOGD : endoscopie œso-gastro-duodénale
GVPH : gradient de pression veineuse hépatique
HTP : hypertension portale
ISLA : infection spontanée de liquide d’ascite
LVO : ligature de varices œsophagiennes
MELD : Model for End stage Liver Disease
RVO : rupture de varices œsophagiennes
pTIPS : Transjugular Intrahepatic Portosystemic Shunt préemptif
TIPS : Transjugular Intrahepatic Portosystemic Shunt
VO : varices œsophagiennes
Mots-clés : Cirrhose, hypertension portale, varices œsophagiennes, ascite, encéphalopathie hépatique, TIPS
Introduction
L’hypertension portale (HTP) est à l’origine des principales complications de la cirrhose. Elle est secondaire à une distorsion de l'architecture vasculaire (fibrose, inflammation chronique, modifications dynamiques de la contractilité des sinusoïdes), entraînant une augmentation des résistances vasculaires intrahépatiques, puis une ouverture des collatérales et une augmentation du flux sanguin splanchnique.
Pour évaluer la présence d'HTP, différentes méthodes existent, mais la mesure du gradient de pression veineuse hépatique (GPVH) reste la méthode de référence. Un gradient de pression > 5 mmHg indique la présence d’une HTP, et des valeurs ≥ 10 mmHg celle d'une HTP cliniquement significative exposant les patients à la survenue de complications (rupture de varices œsophagiennes [RVO], ascite, encéphalopathie hépatique [EH]) impactant le pronostic des patients. Limiter la survenue de ces complications est un enjeu majeur chez les patients cirrhotiques afin d’améliorer leur pronostic. Récemment, la conférence de consensus Baveno VII a recommandé de traiter par alpha-bêta bloquant (carvedilol) ou bêta-bloquants non cardiosélectifs (BBNS) (propranolol ou nadolol) tous les patients cirrhotiques compensés présentant une HTP cliniquement significative afin de limiter la survenue d’une décompensation hépatique et d’augmenter leur survie [1–3]. Un dépistage approprié de l’HTP cliniquement significative est donc nécessaire.
Dépistage et surveillance de l’HTP
Dépistage de l’HTP
Avant les recommandations Baveno VII, la prophylaxie par BBNS était recommandée en prévention du risque hémorragique chez les patients identifiés à risque d’hémorragie digestive liée à l’HTP. Le paradigme a évolué et le traitement par BBNS est maintenant recommandé afin de prévenir la décompensation de la maladie hépatique ou le décès.
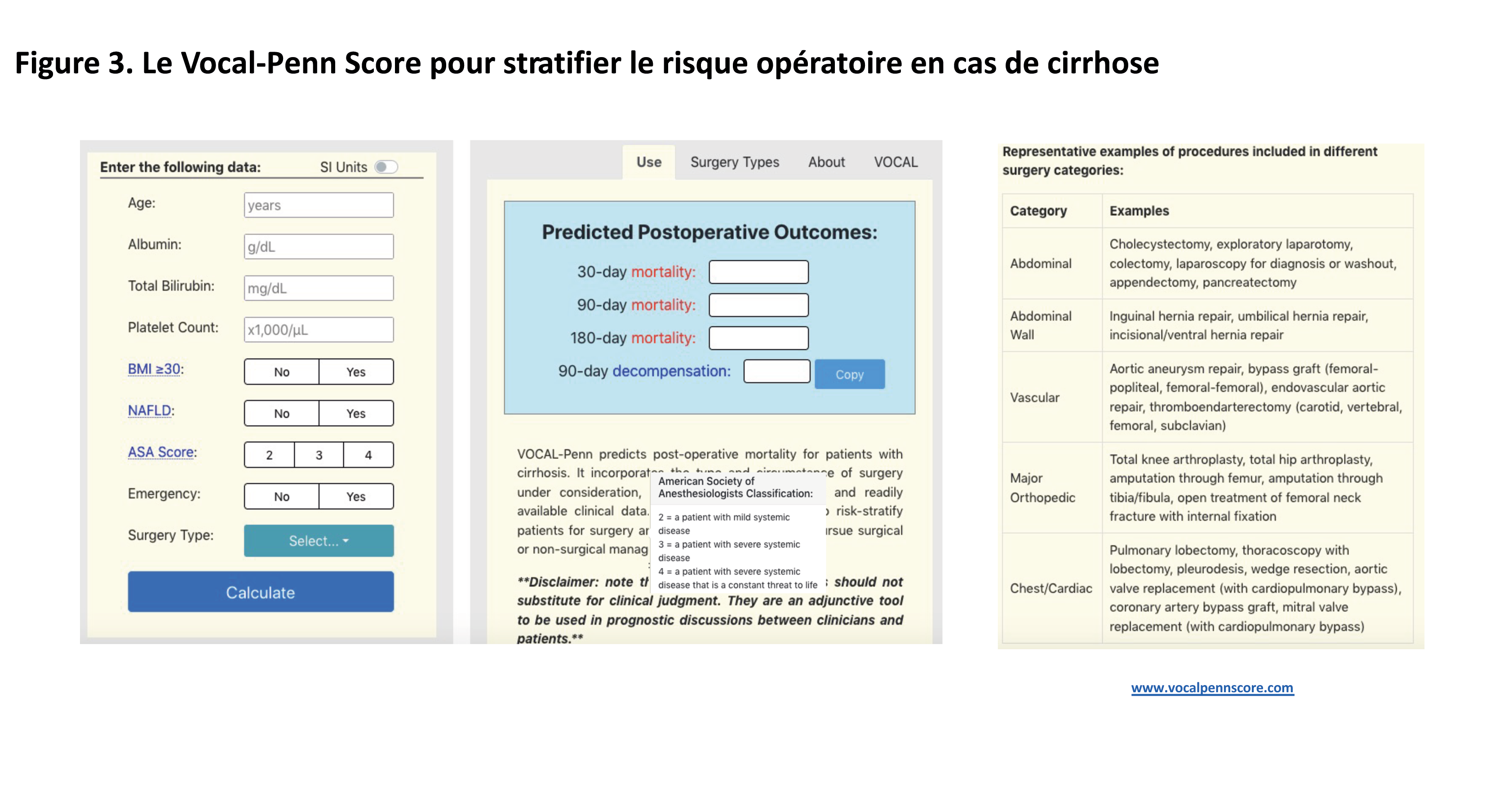
La mesure du GVPH étant un acte invasif, des critères non invasifs ont été validés ces dernières années afin d’identifier les patients avec HTP cliniquement significative lorsque l’hépatopathie chronique avancée est compensée. L’intérêt des BBNS et de l’alpha-bêta bloquant carvedilol a été démontré chez ces patients dans l’étude PREDESCI [2] et dans une méta-analyse récente [3], en prévenant la décompensation ou le décès chez les patients présentant une cirrhose compensée. Par extrapolation, il a été proposé, dans les recommandations Baveno VII et suite aux résultats d’une étude internationale, de considérer une HTP cliniquement significative devant une élasticité hépatique ≥ 25 kPa dans un contexte d’hépatopathie chronique avancée compensée liée à l’alcool, post-virale ou liée à une stéatopathie métabolique non obèse (IMC < 30 kg/m²) [4]. Par ailleurs, en raison de son effet plus important sur la diminution du gradient de pression hépatique, le carvedilol a été choisi en première intention, par rapport aux BBNS, qui peuvent aussi être utilisés. Un traitement par carvedilol est donc indiqué chez ces patients, sans nécessité de dépistage des varices œsophagiennes (VO) à l’endoscopie œso-gastro-duodénale (EOGD), en prévention de la décompensation hépatique [1]. Par ailleurs, le risque d’HTP cliniquement significative est faible chez les patients ayant un taux de plaquettes ≥ 150 G/L et une élasticité hépatique ≤ 15 kPa (Se et VPN > 90 %), suggérant qu’il n’y aura aucune indication à prescrire du carvedilol en prophylaxie chez ces patients (qui d’ailleurs, par déduction, n’ont pas non plus de varices puisque pas d’HTP significative).
Ainsi, il est possible d’estimer la probabilité d’avoir une HTP significative ou pas chez les patients avec une élasticité hépatique ≥ 25 kPa (forte probabilité, prévention par carvedilol) ou chez ceux avec une élasticité hépatique ≤ 15 kPa et des plaquettes ≥ 150 G/L (très faible probabilité, pas de prévention).
Chez les patients n’appartenant à aucune de ces catégories, le dépistage non-invasif de l’HTP significative est trop imprécis, et la mesure du gradient n’est pas effectuée en routine. Pourtant, certains bénéficieront d’une prophylaxie. Pour l’instant, le choix est donc pour ces patients d’en rester aux anciennes indications de la prévention, c’est-à-dire les varices œsophagiennes. Il convient donc d’effectuer une EOGD chez ces patients, ayant une hépatopathie chronique avancée compensée associée à un taux de plaquettes < 150 G/L et/ou une élasticité hépatique en zone grise entre 15 et 25 kPa (Figure 1). Chez ces patients, un traitement par BBNS est indiqué en cas de VO à l’EOGD, quelle que soit leur taille, puisque les patients ayant des VO de petite taille ont par définition une HTP significative.
Ces conclusions de la conférence de Baveno VII, rapportées ici, reposent cependant sur peu d’études et sont discutées par certaines équipes ; un intérêt particulier sera porté sur la validation de cette attitude diagnostique et thérapeutique par de nouveaux essais. Enfin, ces recommandations ne s’appliquent qu’aux patients ayant une cirrhose compensée, et le dépistage endoscopique reste de mise chez les patients décompensés qui ne sont pas sous BBNS ou carvedilol. De la même façon, il est probable qu’il faille continuer le dépistage endoscopique chez les patients ayant un CHC [5].
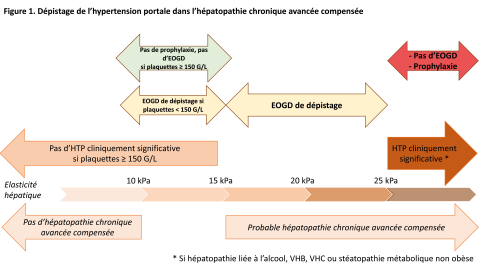
Figure 1. Dépistage de l’hypertension portale dans l’hépatopathie chronique avancée compensée.
Abréviations : EOGD : endoscopie œso-gastro-duodénale ; HTP : hypertension portale ; VHB : virus de l’hépatite B ; VHC : virus de l’hépatite C ; VO : varices œsophagiennes.
|
· Cirrhose avec ascite
· Insuffisance rénale aiguë selon les critères AKIN sans limite de créatinine :
o Stade I : créatinine sérique entre 150 et 200 % de la valeur habituelle (1,5-2N)
o Stade II : créatinine sérique entre 200 et 300 % de la valeur habituelle (2-3N)
o Stade III : créatinine sérique > 300 % de la valeur habituelle (> 3N)
· Absence de choc
· Absence d’amélioration des valeurs de créatinine après un remplissage par albumine IV (1g/kg/j) jusqu’à un maximum de 100 g/j et arrêt des traitements diurétiques pendant 48 heures
· Absence de traitements néphrotoxiques
· Absence de pathologie rénale intrinsèque
· Absence de protéinurie (> 500 mg/j)
· Absence de micro-hématurie (> 40 GR par champ)
· Absence d’obstacle à l’échographie réno-vésicale
|
Tableau : critères diagnostiques du syndrome hépatorénal
Surveillance de l’HTP
Chez les patients ayant une hépatopathie chronique avancée compensée n’ayant pas de prévention primaire de la décompensation, il est recommandé de réévaluer annuellement la présence d’une HTP significative selon la numération plaquettaire et l’élasticité hépatique [2]. Cette surveillance peut être interrompue chez les patients avec hépatopathie chronique avancée compensée liée à l’hépatite C ayant eu une réponse virologique soutenue, chez lesquels il a été démontré récemment que le risque de décompensation était nul sur un suivi de 3 ans si élasticité hépatique < 12 kPa et plaquettes > 150 G/L (Se 99,2 %), en l’absence de co-facteur d’hépatopathie bien entendu [6].
Chez les patients traités par carvedilol ou BBNS pour une indication de varices, la poursuite du traitement au long cours peut se discuter après disparition du facteur étiologique principal de la cirrhose, celle-ci permettant une diminution significative du GVPH chez une majorité des patients [7]. Ainsi, une EOGD de contrôle peut être effectuée afin de discuter l’arrêt des BBNS si disparition des varices 1 en l’absence d’HTP cliniquement significative évidente (élasticité hépatique < 25 kPa, mais toujours > 15 kPa ou plaquettes < 150 G/L) et 1 à 2 an(s) après disparition du facteur étiologique principal de la cirrhose (virosuppression de l’hépatite B en l’absence de co-infection par le virus de l’hépatite D, réponse virologique soutenue pour l’hépatite C et sevrage en alcool au long cours pour les hépatopathies liées à l’alcool) et en l’absence de co-facteur d’hépatopathie (surpoids, diabète et consommation d’alcool) [8].
Traitement des complications de l’hypertension portale
Les principales complications de l’HTP sont l’hémorragie digestive par rupture de varices, l’ascite et l’EH.
L’hémorragie digestive
L’hémorragie par RVO est la première cause d’hémorragie digestive (70 %) chez les patients avec une cirrhose. La rupture de varices gastriques est plus rare. Leur prise en charge, en unité de soins critiques, repose sur des mesures classiques de réanimation, l’administration d’un traitement vasoactif (somatostatine, octréotide ou terlipressine), une antibioprophylaxie par céfotaxime, la prévention de l’EH par lactulose, et sur le traitement endoscopique (ligature de varices œsophagiennes [LVO] ou encollage de varices gastriques) [1]. En cas d’échec du traitement endoscopique, un TIPS (Transjugular Intrahepatic Portosystemic Shunt) dit « de sauvetage » doit être discuté. Dans l’attente de cette thérapeutique, un tamponnement œsophagien (par sonde de Blakemore ou la pose de prothèse œsophagienne couverte) doit être effectué. Les patients ayant un score de Child-Pugh>C13 d’une part, ou un MELD>30 et/ou un taux de lactate artériel > 12 mmol/L ont une survie sans transplantation à 6 semaines < 10 % et ne bénéficient probablement pas de la pose d’un TIPS de sauvetage [9], sauf si une transplantation hépatique (TH) est envisageable dans les suites [10]. La décision se fait au cas par cas, en discutant avec un centre expert du TIPS.
L’intérêt de la pose d’un TIPS préemptif (pTIPS) est maintenant clair en cas de contrôle de l’hémorragie. Il doit être posé dans les 72 h après l’EOGD chez les patients stabilisés, à haut risque de récidive hémorragique, c’est-à-dire les patients Child-Pugh B>7 avec saignement actif lors de l’EOGD ou Child-Pugh C<14 [1]. Celui-ci améliore la survie des patients et diminue fortement le risque de récidive hémorragique [1]. Il est recommandé dans la dernière conférence de consensus de Baveno VII [1]. Il est également souligné que les patients les plus sévères en tirent un bénéfice sur la survie (patients ictériques, avec Acute on Chronic Liver Failure, ou EH) [11] et on ne doit pas contre-indiquer le pTIPS chez ces patients. S’il n’y a pas d’indication à un pTIPS, un traitement par BBNS doit être introduit et des ligatures itératives doivent être effectuées toutes les 3 à 4 semaines jusqu’à éradication complète des varices en prévention secondaire de la RVO. Enfin, le TIPS doit être proposé en cas de récidive hémorragique malgré une prévention secondaire (par BBNS et ligatures itératives) bien conduite dans les cas où les critères du pTIPS n’étaient pas présents.
L’ascite
L’ascite est la complication la plus fréquente de la cirrhose et de l’HTP. En cas de première poussée d’ascite, il est recommandé d’effectuer une ponction d’ascite exploratrice pour analyser le liquide en biochimie, bactériologie et anatomopathologie. Ceci a pour objectif d’authentifier l’origine hépatique de l’ascite et d’écarter les diagnostics différentiels tels que la carcinose péritonéale, l’ascite d’origine cardiaque et l’ascite tuberculeuse qui sont riches en protides (>20 g/L). Il conviendra également d’éliminer une autre cause d’ascite pauvre en protides (syndrome néphrotique, dénutrition). L’analyse en bactériologie permettra également de poser le diagnostic d’infection spontanée du liquide d’ascite (ISLA), si les polynucléaires neutrophiles sont >250/mm3.
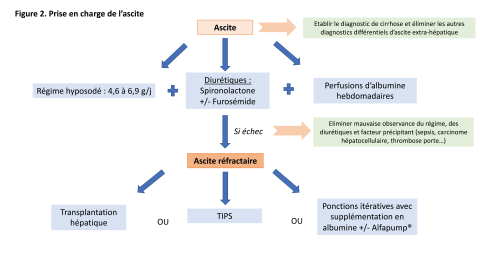
La base du traitement de l’ascite consiste en la prescription d’un régime hyposodé, avec un objectif d’apport en sel de 80 à 120 mmol/j (soit 4,6 à 6,9 g/j) 12. La spironolactone est le diurétique utilisé en première intention car ayant une action anti-aldostérone, à la posologie initiale de 75 mg/j avec une dose maximale de 400 mg/j selon les recommandations européennes. Le furosémide peut être débuté de façon concomitante ou dans un second temps, à la dose de 40 mg/j et peut être augmenté jusqu’à 160 mg/j. On surveille l’efficacité du traitement avec la mesure du poids du patient, la perte pondérale ne devant pas excéder 0,5 à 1 kg par jour. L’objectif est d’obtenir une dose minimale efficace sans effets délétères : pression artérielle systolique ≤ 90 mmHg, hyponatrémie < 130 mmol/L, dyskaliémie et insuffisance rénale aiguë. La survenue d’une gynécomastie douloureuse impose l’arrêt de la spironolactone. Une étude récente a montré un bénéfice de survie grâce à des perfusions hebdomadaires d’albumine (40 g d’albumine par semaine) chez des patients ayant une cirrhose décompensée avec de l’ascite mais ne nécessitant pas de ponctions itératives, principalement par un effet anti-inflammatoire et par diminution de la dysfonction cardio-circulatoire propre de la cirrhose [13].
En cas d’ascite non contrôlable par les diurétiques ou lorsque ces derniers sont contre-indiqués, on parle d’ascite réfractaire : le patient nécessite des ponctions évacuatrices itératives. Rappelons la nécessité de supplémenter en albumine en cas d’évacuation d’ascite > 5 L (8 g d’albumine par litre d’ascite évacuée) pour diminuer le risque d’apparition d’une dysfonction circulatoire et d’une insuffisance rénale aiguë. En cas d’ascite réfractaire et d’hypotension, d’insuffisance rénale ou d’ISLA, les BBNS doivent être arrêtés (et une autre prophylaxie des varices doit être mise en place le cas échéant). On souligne que, chez des patients ayant une ascite, une insuffisance rénale fonctionnelle peut survenir ; en l’absence de réponse au remplissage, on parle de syndrome hépatorénal, dont les critères diagnostiques ont été modifiés récemment (Tableau).
|
• Cirrhose avec ascite
• Insuffisance rénale aiguë selon les critères AKIN sans limite de créatinine : • Absence de choc • Absence d’amélioration des valeurs de créatinine après un remplissage par albumine IV (1g/kg/j) jusqu’à un maximum de 100 g/j et arrêt des traitements diurétiques pendant 48 heures • Absence de traitements néphrotoxiques • Absence de pathologie rénale intrinsèque • Absence de protéinurie (> 500 mg/j) • Absence de micro-hématurie (> 40 GR par champ) • Absence d’obstacle à l’échographie réno-vésicale
|
Du fait du mauvais pronostic (survie de 50 % à 1 an) des patients atteints d’ascite réfractaire, il est important de référer le patient en centre expert pour discuter du TIPS ou de la TH. En effet, la pose d’un TIPS permet d’améliorer la survie sans transplantation des patients par rapport à ceux qui sont traités par ponctions itératives [14]. Dans cette perspective, la sélection des patients est primordiale : le TIPS est contre-indiqué chez les patients ayant une insuffisance hépatique sévère (Child-Pugh >13 ou avec un score Model for End stage Liver Disease [MELD] > 19), une insuffisance cardiaque, une hypertension artérielle pulmonaire, une dilatation des voies biliaires, ou 2 antécédents d’EH [15]. Un algorithme décisionnel simple a été proposé dans l’ascite réfractaire pour sélectionner des malades avant pose de TIPS programmé : un taux de plaquettes > 75 000/mm3 et une bilirubinémie < 50 µmol/l sont associés à un meilleur pronostic [16]. Dans notre centre, la décision de pose d’un TIPS se prend lors d’un staff pluridisciplinaire au cours duquel doit également se poser la question d’une TH [17]. En effet, il peut survenir une insuffisance hépatique sévère dans les suites du TIPS et statuer sur le projet de TH avant la pose du TIPS est primordial. Enfin, un traitement palliatif, « l’Alfapump® » qui dérive l’ascite vers la vessie a une efficacité démontrée sur la diminution des ponctions d’ascite et l’amélioration de la qualité de vie 18. L’ensemble de ces traitements est rappelé dans la Figure 2.
L’encéphalopathie hépatique
L’EH est définie par l’ensemble des troubles neurologiques et neuropsychiatriques rencontrés au cours des maladies du foie ou chez des patients ayant des shunts porto-systémiques. Les signes les plus fréquents sont : un astérixis, un ralentissement psychomoteur et une inversion du cycle nycthéméral. En cas d’EH plus sévère, il peut survenir des troubles de la conscience allant jusqu’au coma. Le dosage de l’ammoniémie a une bonne valeur prédictive négative et une valeur normale remet en cause le diagnostic d’EH [19]. Il ne faut pas toujours imputer l’EH à chaque trouble neurologique du patient ayant une cirrhose mais éliminer également les autres causes de trouble de la conscience de l’adulte.
La base du traitement de l’EH repose sur : 1) l’évaluation de la gravité, qui détermine le lieu de prise en charge du patient ; 2) la recherche et le traitement du facteur précipitant ; 3) un traitement hypoammoniémiant ; 4) la prévention de la récidive.
Le traitement hypoammoniémant recommandé en première intention est le lactulose, un disaccharide non absorbable, qui a un effet laxatif et qui favorise l’élimination des bactéries coliques productrices d’ammoniaque. S’il est mal toléré ou insuffisamment efficace, on peut utiliser en deuxième intention la rifaximine, un antibiotique peu absorbable par voie digestive. Toutefois, malgré une efficacité prouvée pour le traitement de la crise, en prévention secondaire, et en prévention primaire pour prévenir la survenue d’une EH après la pose d’un TIPS (étude française sur 197 patients, où 34 % dans le groupe rifaximine ont développé une EH versus 53 % dans le groupe placebo) [20], la rifaximine n’est autorisée théoriquement qu’en prévention secondaire après un deuxième épisode d’EH. L’éducation thérapeutique du patient et de l’entourage est importante, notamment sur les traitements pouvant précipiter l’EH (benzodiazépines, hypnotiques…). En cas d’EH réfractaire, il est licite de discuter d’une TH.
Chirurgie abdominale en cas d’hypertension portale
Du fait de l’amélioration du pronostic de la cirrhose, les indications à une chirurgie abdominale hépatique ou extra-hépatique sont en augmentation. Cependant, les malades atteints de cirrhose sont plus à risque de développer des complications post opératoires, notamment ceux présentant une HTP. Parmi ces complications, les plus fréquemment observées sont la survenue d’ascite, les infections bactériennes et l’insuffisance rénale [21]. Comme l’ascite et l’HTP sont des facteurs associés à la morbi-mortalité post-opératoire, le diagnostic préopératoire de l’HTP est primordial car il modifie la stratégie chirurgicale [22]. L’évaluation du risque opératoire repose également sur l’évaluation de la fonction hépatique, le type d’intervention et les comorbidités. L’information du patient et de son entourage des risques post-opératoires est également majeure et l’ensemble des alternatives à un traitement chirurgical doivent être discutées chez les patients à risque.
Chirurgie hépatique chez les patients atteints d’hypertension portale
La chirurgie hépatique est un des traitements curatifs des tumeurs cancéreuses primitives hépatiques et est principalement envisagée chez les patients présentant une cirrhose compensée et une tumeur hépatique unique [23]. La présence d’une HTP cliniquement significative est associée à un risque de décompensation hépatique et de décès à long terme 2 à 22 fois plus élevé respectivement [24]. En l’absence de signe évident d’HTP, il est recommandé d’effectuer une mesure de gradient de pression hépatique par voie transjugulaire pour statuer sur l’existence ou non d’une HTP cliniquement significative (supérieur ou égal à 10 mmHg). Le risque de décompensation hépatique augmente avec l'étendue de l'hépatectomie. En cas d’HTP cliniquement significative, le taux de mortalité lié à la cirrhose est de 25 % après une hépatectomie majeure contre 9 % après une hépatectomie mineure [25]. À noter que les dernières recommandations de l'EASL n'excluent pas formellement la chirurgie hépatique en cas d’HTP cliniquement significative si une hépatectomie mineure est considérée chez un patient présentant un score MELD < 10 avec une approche chirurgicale par voie laparoscopique. Il existe toutefois un risque important d'insuffisance hépatique postopératoire pour des valeurs d’élasticité hépatique supérieures à 12-14 kPa [25].
Chirurgie extra-hépatique chez les patients atteints d’hypertension portale
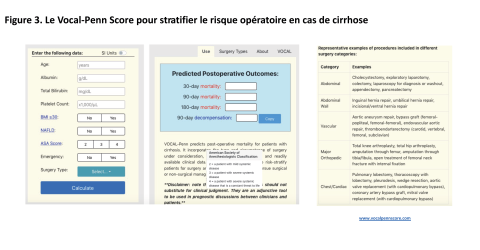
Les interventions extra-hépatiques fréquemment discutées en cas de cirrhose sont la cholécystectomie, la chirurgie colorectale et la chirurgie de paroi. Certains facteurs ont été associés à une morbi-mortalité accrue en cas de chirurgie abdominale chez les patients cirrhotiques comme la sévérité de la cirrhose (scores de MELD et Child-Pugh) mais également la présence de varices œsophagiennes et d’ascite signant une HTP cliniquement significative [22]. De plus, une augmentation de la mortalité post opératoire a été observée chez les patients avec un gradient de pression > 16 mmHg après chirurgie extra-hépatique [26]. Plus récemment, le score Vocal-Penn facilement accessible par le site www.vocalpennscore.com, a montré une meilleure performance pronostique que le MELD, le MELD-Na et le score de Child Pugh dans la prédiction de la mortalité post-chirurgie, à 30, 90 et 180 jours (Figure 3) [27, 28]. Il est ainsi préconisé de recourir au score Vocal-Penn avant chirurgie du patient cirrhotique pour évaluer son risque opératoire et valider ou non son indication opératoire. En cas de risque trop élevé, des méthodes alternatives doivent être considérées. De plus, chez les candidats à une TH, il est recommandé de finaliser le bilan pré-greffe avant l’intervention chirurgicale, au cas où une décompensation grave survenait en post-opératoire.
Les interventions chirurgicales abdominales effectuées en urgence sont associées à des complications post-opératoires plus élevées que les chirurgies programmées chez les patients atteints de cirrhose, plus particulièrement chez les patients décompensés [21]. Idéalement, l'intervention chirurgicale devrait être retardée jusqu'à ce que le patient soit stabilisé. La décision d’une chirurgie abdominale urgente doit être discutée au cas par cas, et il est nécessaire d’envisager des alternatives non chirurgicales chez les patients à risque et de préférer des approches mini-invasives lorsque la chirurgie est nécessaire.
Préparation à la chirurgie
Dans le cas d’une chirurgie programmée, la mise en place d’un TIPS préparatoire chez les patients présentant une HTP cliniquement significative peut être discutée par des équipes expertes de façon à améliorer les suites post-opératoires, particulièrement chez des patients décompensés, mais il n’y pas de données suffisantes pour recommander un TIPS de façon systématique chez des malades ayant une cirrhose compensée, même avec une HTP sévère et l’indication est à discuter au cas par cas [29].
Mesures postopératoires
La prise en charge post opératoire des patients atteints de cirrhose a pour objectif de prévenir la survenue de complications liée à la maladie hépatique. Il est recommandé de
1) limiter les médicaments métabolisés par le foie (paracétamol) et les sédatifs,
2) proscrire les agents néphrotoxiques (anti inflammatoires non stéroïdiens, aminosides, produit de contraste),
3) prévenir la survenue d’une hypovolémie et d’une constipation,
4) dépister précocement la survenue d’infection bactérienne.
Dans le cas où les patients doivent rester à jeun, il est conseillé de débuter une nutrition parentérale précoce, ce d’autant plus que la dénutrition est associée à une augmentation des complications post opératoires en cas de cirrhose.
Conclusion
L’HTP est à l’origine des principales complications de la cirrhose, impactant ainsi le pronostic des patients. Un dépistage adapté de l’HTP est primordial afin d’identifier les patients à risque de décompensation et pouvant bénéficier d’une prophylaxie lorsqu’elle est indiquée. Une prise en charge adaptée des complications liées à l’HTP apparait également comme un enjeu majeur afin d’améliorer le pronostic des patients atteints de cirrhose.
Date de l'article : Juin 2023
References
Références
- de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C, Abraldes JG, et al. Baveno VII – Renewing consensus in portal hypertension. J Hepatol. 2022;76(4):959‑74.
- Villanueva C, Albillos A, Genescà J, Garcia-Pagan JC, Calleja JL, Aracil C, et al. β blockers to prevent decompensation of cirrhosis in patients with clinically significant portal hypertension (PREDESCI): a randomised, double-blind, placebo-controlled, multicentre trial. The Lancet. 2019;393(10181):1597‑608.
- Villanueva C, Torres F, Sarin SK, Shah HA, Tripathi D, Brujats A, et al. Carvedilol reduces the risk of decompensation and mortality in patients with compensated cirrhosis in a competing-risk meta-analysis. J Hepatol. 2022;S0168-8278(22)00336-1.
- Abraldes JG, Bureau C, Stefanescu H, Augustin S, Ney M, Blasco H, et al. Noninvasive tools and risk of clinically significant portal hypertension and varices in compensated cirrhosis: The « Anticipate » study. Hepatology. 2016;64(6):2173‑84.
- Allaire M, Thabut D. Portal hypertension and variceal bleeding in patients with liver cancer: Evidence gaps for prevention and management. Hepatology. 2023; doi: 10.1097/HEP.0000000000000291
- Semmler G, Lens S, Meyer EL, Baiges A, Alvardo-Tapias E, Llop E, et al. Non-invasive tests for clinically significant portal hypertension after HCV cure. J Hepatol. 2022;77(6):1573‑85.
- Di Marco V, Calvaruso V, Ferraro D, Bavetta MG, Cabibbo G, Conte E, et al. Effects of Eradicating Hepatitis C Virus Infection in Patients With Cirrhosis Differ With Stage of Portal Hypertension. Gastroenterology. 2016;151(1):130-139.e2.
- Berzigotti A, Garcia-Tsao G, Bosch J, Grace ND, Burroughs AK, Morillas R, et al. Obesity is an independent risk factor for clinical decompensation in patients with cirrhosis. Hepatology. 2011;54(2):555‑61.
- Walter A, Rudler M, Olivas P, Moga L, Trépo E, Robic MA, et al. Combination of MELD and lactate predicts death in patients treated with salvage TIPS for refractory variceal bleeding. Hepatology. 2021;74(4):2086-2101.
- Bouzbib C, Cluzel P, Sultanik P, Bernard-Chabert B, Massard J, Benosman H, et al. Prognosis of patients undergoing salvage TIPS is still poor in the preemptive TIPS era. Clin Res Hepatol Gastroenterol. 2021;45(6):101593.
- Rudler M, Hernández-Gea V, Procopet BD, Giráldez A, Amitrano L, Villanueva C, et al. Hepatic encephalopathy is not a contraindication to pre-emptive TIPS in high-risk patients with cirrhosis with variceal bleeding. Gut. 2022;doi: 10.1136/gutjnl-2022-326975.
- Angeli P, Bernardi M, Villanueva C, Francoz C, Mookerjee RP, Trebicka J, et al. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018;69(2):406‑60.
- Caraceni P, Riggio O, Angeli P, Alessandria C, Neri S, Foschi FG, et al. Long-term albumin administration in decompensated cirrhosis (ANSWER): an open-label randomised trial. Lancet Lond Engl. 2018;391(10138):2417‑29.
- Salerno F, Cammà C, Enea M, Rössle M, Wong F. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology. 2007;133(3):825‑34.
- Rudler M, Mallet M, Sultanik P, Bouzbib C, Thabut D. Optimal management of ascites. Liver Int. 2020;40(S1):128‑35.
- Bureau C, Métivier S, D’Amico M, Péron JM, Otal P, Pagan JCG, et al. Serum bilirubin and platelet count: a simple predictive model for survival in patients with refractory ascites treated by TIPS. J Hepatol. 2011;54(5):901‑7.
- Rudler M, Savier E, Alioua I, Sultanik P, Thabut D. TIPS and liver transplantation should always be discussed together. J Hepatol. 2021;75(4):1000‑1.
- Bureau C, Adebayo D, Chalret de Rieu M, Elkrief L, Valla D, Peck-Radosavljevic M, et al. Alfapump® system vs. large volume paracentesis for refractory ascites: A multicenter randomized controlled study. J Hepatol. 2017;67(5):940‑9.
- European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu, European Association for the Study of the Liver. EASL Clinical Practice Guidelines on the management of hepatic encephalopathy. J Hepatol. 2022;77(3):807‑24.
- Bureau C, Thabut D, Jezequel C, Archambeaud I, D’Alteroche L, Dharancy S, et al. The Use of Rifaximin in the Prevention of Overt Hepatic Encephalopathy After Transjugular Intrahepatic Portosystemic Shunt : A Randomized Controlled Trial. Ann Intern Med. 2021;174(5):633‑40.
- Neeff HP, Streule GC, Drognitz O, Tittelbach-Helmrich D, Spangenberg HC, Hopt UT, et al. Early mortality and long-term survival after abdominal surgery in patients with liver cirrhosis. Surgery. 2014;155(4):623‑32.
- Ziser A, Plevak DJ, Wiesner RH, Rakela J, Offord KP, Brown DL. Morbidity and mortality in cirrhotic patients undergoing anesthesia and surgery. Anesthesiology. 1999;90(1):42‑53.
- Allaire M, Goumard C, Lim C, Le Cleach A, Wagner M, Scatton O. New frontiers in liver resection for hepatocellular carcinoma. JHEP Rep. 2020;2(4):100134.
- Berzigotti A, Reig M, Abraldes JG, Bosch J, Bruix J. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: a systematic review and meta-analysis. Hepatology. 2015;61(2):526‑36.
- European Association For The Study Of The Liver, European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56(4):908‑43.
- Reverter E, Cirera I, Albillos A, Debernardi-Venon W, Abraldes JG, Llop E, et al. The prognostic role of hepatic venous pressure gradient in cirrhotic patients undergoing elective extrahepatic surgery. J Hepatol. 2019;71(5):942‑50.
- Mahmud N, Fricker Z, Hubbard RA, Ioannou GN, Lewis JD, Taddei TH, et al. Risk Prediction Models for Post-Operative Mortality in Patients With Cirrhosis. Hepatology. janv 2021;73(1):204‑18.
- Mahmud N, Fricker Z, Panchal S, Lewis JD, Goldberg DS, Kaplan DE. External Validation of the VOCAL-Penn Cirrhosis Surgical Risk Score in 2 Large, Independent Health Systems. Liver Transpl. 2021;27(7):961‑70.
-
García-Pagán JC, Saffo S, Mandorfer M, Garcia-Tsao G. Where does TIPS fit in the management of patients with cirrhosis? JHEP Rep Innov Hepatol. 2020;2(4):100122.


Photo%20Manon%20Allaire%20AFEF.jpg)